
© Eric Boulommie
A preservação dos recursos genéticos de espécies aquáticas ameaçadas de extinção tem assumido uma importância cada vez maior nos últimos anos. Como resultado dos avanços na ciência da criopreservação, tornou-se bastante fácil congelar o esperma de muitas espécies aquáticas, mas os óvulos maduros e os embriões em desenvolvimento são outra história, pelo menos para os peixes.
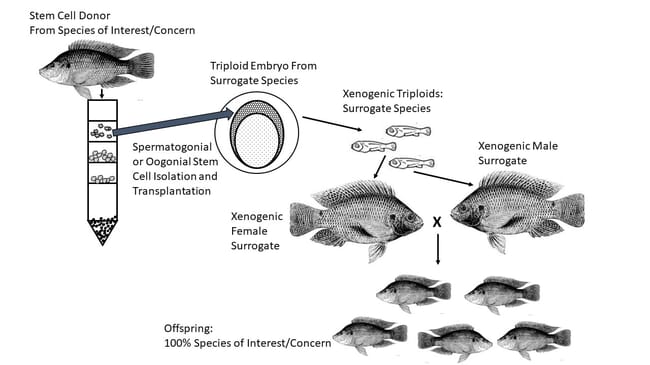
O tamanho comparativamente grande, o alto conteúdo de gema e a permeabilidade limitada da membrana geralmente dificultam ou impedem a criopreservação, mas nos últimos anos foi demonstrada uma solução viável. Os tecidos e/ou células que se desenvolvem nos ovos de peixe podem ser criopreservados, posteriormente descongelados e transplantados em peixes receptores estéreis. Esses receptores substitutos podem ser da mesma espécie, de espécies relacionadas ou, em alguns casos, de espécies completamente não relacionadas. Quando tudo funciona, o peixe receptor desenvolve gametas masculinos ou femininos funcionais com material genético do doador original. Como resultado, essa abordagem oferece vantagens distintas para a conservação de espécies ameaçadas ou em perigo de extinção.
A ciência (simplificada)
Essas novas fronteiras na conservação aquática estão concentradas no uso de células germinativas e células-tronco gonadais, sendo que as últimas emergem como o material de escolha quando se trabalha com peixes. Sem entrar em detalhes excessivos, as células-tronco são basicamente células indiferenciadas que podem se multiplicar em muitas outras células do mesmo tipo, permanecer dormentes ou se diferenciar para assumir funções específicas. Diferentes tecidos e órgãos, inclusive os tecidos gonadais dos peixes, normalmente contêm algumas células-tronco que podem se desenvolver em células novas e diferenciadas. Para resumir brevemente as origens desses tecidos gonadais, bem no início do desenvolvimento dos embriões de peixes é possível distinguir dois tipos fundamentais de células: células germinativas e células somáticas. À medida que as células somáticas começam a formar a totalidade do organismo, as células germinativas encontram o caminho para os tecidos que se tornarão ovários ou testículos e começam a se proliferar.
Se as células-tronco gonadais (ou tecidos espermatogoniais ou oogoniais adequados) de peixes doadores puderem ser criopreservadas e recuperadas com sucesso, elas poderão ser introduzidas em indivíduos substitutos, onde funcionarão como células germinativas, migrando para o local interno apropriado e se desenvolvendo em gônadas funcionais (Yoshizaki e Lee 2018). Os peixes receptores são previamente esterilizados, seja por meio da indução de triploidia ou supressão de células gonadais nativas. E, em muitos casos, os receptores podem ser de espécies diferentes. Quando os receptores são de uma espécie diferente da do doador, mesmo que estejam intimamente relacionados, eles são chamados de "xenógenos" Vários resultados de pesquisas recentes confirmam que essa abordagem representa uma nova e poderosa ferramenta para a preservação de recursos genéticos em várias espécies de peixes.
Ele realmente funciona?
Em 2010, Lacerda et al. relataram os esforços para realizar o transplante de células-tronco espermatogoniais em tilápias. Eles transplantaram células-tronco frescas ou criopreservadas de uma linhagem de tilápia em machos previamente esterilizados de outra linhagem. As células-tronco criopreservadas se desenvolveram em espermatozóides nos peixes receptores, com uma taxa de colonização de 88%. Os machos receptores acabaram produzindo espermatozóides viáveis e geraram descendentes com o genótipo da linhagem doadora.
No mesmo ano, Yoshizaki et al. demonstraram que, quando transplantadas para alevinos recém-eclodidos, as células germinativas do ovário da truta arco-íris acabaram se diferenciando em óvulos nas fêmeas receptoras e em espermatozoides nos machos receptores. Resultados semelhantes foram relatados em outros peixes, e essa plasticidade baseada em receptores também pode fornecer uma abordagem alternativa para a cultura monossexo em várias espécies.
© Greg Lutz
Em 2012 Lee et al. conseguiram transplantar espermatagônias previamente congeladas em filhotes triploides de truta arco-íris. Quase metade desses peixes passou a produzir óvulos ou espermatozoides funcionais, dependendo de seu sexo fenotípico, que, quando combinados, resultaram em descendentes normais. Da mesma forma, em 2016, Lee e Yoshizaki demonstraram a criopreservação, o descongelamento e o transplante de células testiculares da truta Manchurian, ameaçada de extinção, em filhotes triploides receptores da mesma espécie. As espermatogônias transplantadas migraram e foram incorporadas ao tecido gonadal dos triploides, com alguns receptores desenvolvendo testículos maduros e outros produzindo ovários maduros. Em uma nota de advertência, em condições reais, essas abordagens exigiriam vários doadores de células-tronco para minimizar os impactos da endogamia, com xenógenos de um doador sendo gerados apenas com os de outros doadores.
Dando um passo adiante com outro peixe ameaçado de extinção, Psenicka et al. (2016) usaram tecido testicular e ovariano em estágio inicial e células do esturjão siberiano para avaliar vários protocolos de manuseio e congelamento. Tanto o tecido inteiro quanto as células dissociadas apresentaram boa sobrevivência após o descongelamento. Quando transplantadas para larvas de esterlina, após 90 dias, elas haviam proliferado em mais da metade dos receptores. E, ampliando ainda mais os limites da distância filogenética entre doadores e receptores, Silva et al. (2016) transplantaram com sucesso células-tronco espermatogoniais do bagre Jundia (Rhamdia quelen) para tilápias do Nilo machos. Os machos de tilápia foram esterilizados antes do transplante usando altas temperaturas e injeções de bisulfan. Em 120 dias após o procedimento, todos os peixes receptores começaram a produzir esperma.
A carpa comum é uma das espécies mais amplamente cultivadas em águas interiores e, ao longo de centenas de anos, foram desenvolvidas várias linhagens distintas. Há preocupações de que algumas dessas variedades "de herança" possam se perder se não forem conservadas. Trabalhando com células oogoniais, Franek et al. (2019) forneceram uma revisão completa dos procedimentos de criopreservação para preservar os recursos genéticos nessa espécie. Curiosamente, doadores imaturos exibindo estágios iniciais de desenvolvimento ovariano forneceram os melhores resultados de criopreservação, provavelmente devido ao fato de suas células ainda terem níveis adequados de permeabilidade da membrana. Yaraş e Çek-Yalniz (2021) também relataram maior sucesso ao isolar células-tronco oogoniais de juvenis de truta marrom, com cerca de 15 cm de comprimento.
Mais recentemente, Ye et al. (2020) desenvolveram um procedimento para criopreservação de células-tronco gonadais do peixe-espada americano e do esturjão de Yangtze. Após um ano de armazenamento criopreservado, essas células foram descongeladas e transplantadas em larvas de esturjão, onde foram incorporadas com sucesso. Essas descobertas, juntamente com as de Psenicka et al. (2016), são especialmente encorajadoras quando se considera que cerca de 80% das espécies sobreviventes de esturjões e peixes-espada em todo o mundo são consideradas ameaçadas ou criticamente ameaçadas pela União Internacional para a Conservação da Natureza.

© Dr Chris Green
Vitrificação imersa em agulha
Existem milhares de linhagens distintas de peixe-zebra na pesquisa biomédica, com mais sendo desenvolvidas a cada mês. Com o objetivo final de uma conservação mais eficiente do germoplasma de zebrafish, Marinović et al. (2018) apresentaram um método viável para a criopreservação de células germinativas de zebrafish em estágio inicial usando espermatogônias e vitrificação imersa em agulha (NIV). Em um estudo de acompanhamento, o grupo apresentou mais resultados de VNI com altas taxas de sucesso. A VNI oferece algumas vantagens distintas na criopreservação de pequenas amostras de tecido. Os requisitos de crioprotetores são reduzidos porque as amostras de tecido são fixadas em uma agulha de acupuntura, colocadas em meio crioprotetor, removidas e colocadas em uma solução de vitrificação e, posteriormente, mergulhadas diretamente em nitrogênio líquido.
Vários dos mesmos pesquisadores dos estudos de Marinović et al. mencionados acima já haviam relatado a otimização de protocolos de VNI para tecido ovariano de salmonídeos em 2017, especificamente tecido ovariano juvenil de truta marrom. E em 2022, alguns do mesmo grupo de pesquisa relataram o uso de NIV usando tecido ovariano nos esturjões Acipenser ruthenus e A. gueldenstaedtii. As células descongeladas colonizaram com sucesso as gônadas dos peixes receptores, e os resultados confirmaram a VNI como uma ferramenta adicional para a conservação de espécies de esturjão ameaçadas de extinção.
Aquicultura de produção
Além de iniciativas de conservação, o uso de reprodutores substitutos oferece vários benefícios potenciais para o aprimoramento genético na aquicultura. Peixes com características superiores ou exclusivas podem fornecer células para transplante em vários receptores, aumentando consideravelmente a produção de descendentes selecionados. Também pode ser possível utilizar espécies receptoras com intervalos de geração relativamente curtos para acelerar os programas de seleção de espécies doadoras que exigem um tempo maior para atingir a maturidade. E, quando híbridos as tecnologias xenogênicas podem oferecer uma alternativa prática à desova artificial em larga escala.
Nos EUA, a aquicultura de bagres tornou-se amplamente dependente de estoques híbridos produzidos com machos de bagre azul (Ictalurus furcatus) e fêmeas de bagre do canal (I. punctatus). Esses híbridos oferecem características superiores em termos de crescimento, conversão alimentar e resistência a doenças. Infelizmente, eles precisam ser produzidos artificialmente em incubadoras devido a incompatibilidades comportamentais que resultam em uma desova volitiva limitada e pouco confiável entre as espécies parentais. E, como os machos de bagre azul não podem ser desovados, eles precisam ser sacrificados no processo, aumentando significativamente as necessidades anuais de reprodutores machos. Pesquisadores da Universidade de Auburn começaram a avaliar o uso de métodos xenogênicos para lidar com essa situação há alguns anos, e o progresso tem sido impressionante.

© Dr Chris Green
Perera et al. (2017) publicaram o primeiro relatório de produção xenogênica de híbridos de channel x blue, embora com resultados muito limitados. Eles transplantaram espermatogônias de bagres azuis em bagres de canal machos triploides e, dois anos depois, coletaram esperma de um desses xenógenos e o usaram com sucesso para fertilizar ovos de bagres de canal, resultando em descendentes híbridos. Pouco tempo depois, Shang et al. relataram o isolamento e o transplante bem-sucedido de células germinativas testiculares de bagre azul em blástulas de bagre do canal. Os machos xenogênicos resultantes do bagre do canal poderiam, em teoria, acasalar naturalmente com as fêmeas do bagre do canal todos os anos após atingir a maturidade, produzindo descendentes híbridos em quantidades comerciais.
Em 2020, Abualreesh et al. desenvolveram e publicaram um protocolo confiável para congelar espermatogônias de bagre-azul, com refinamentos adicionais
em 2021. Percebendo que ter células-tronco congeladas em repositórios teria um potencial real para avançar na produção em escala comercial de bagres híbridos, os pesquisadores de Auburn continuaram e, em 2022, Hettiarachchi et al. demonstraram a produção de xenógenos de bagres do canal usando tecidos testiculares e ovarianos criopreservados de bagres azuis.
Essa pesquisa continua em Auburn, com métodos e protocolos em constante avanço, mas algumas novas aplicações também podem estar surgindo. Normalmente, não se considera as ovas de peixe como uma mercadoria especialmente valiosa, com exceção do caviar. Especialmente o caviar de esturjão. Em 2023, Jacob Al-Armanazi concluiu sua tese de mestrado em Auburn. Um dos focos de sua pesquisa envolveu o transplante de células-tronco oogoniais e espermatogoniais do esturjão do lago para o bagre híbrido triploide (bagre branco x bagre azul) e do esturjão siberiano para o bagre do canal triploide. Quase 89% dos bagres híbridos receptores apresentaram proliferação de células-tronco do esturjão do lago e, embora os resultados não tenham sido tão impressionantes para o bagre do canal transplantado, as células-tronco do esturjão siberiano persistiram em quase 77% dos receptores.
Resumindo, à medida que nosso entendimento e domínio da produção de xenogenia em peixes avança, vários benefícios podem ser obtidos. A conservação e a preservação do germoplasma continuarão a ser uma preocupação significativa em todo o mundo, para todos aqueles que trabalham com espécies de peixes ameaçadas e em perigo de extinção e também para vários setores da aquicultura comercial. Nos próximos anos, a criopreservação e o subsequente transplante de células-tronco gonadais assumirão uma importância cada vez maior em várias espécies de peixes.







